RESUMEN Objetivo: Describir y documentar un caso de carcinoma epidermoide en región inguinal. Método: En consulta de Dermatología especializada del Hospital Clínico Quirúrgico Docente “Celia Sánchez Manduley”; es atendido paciente masculino de 60 años de edad y raza mestiza, por presentar lesiones verrugosas en regiones inguinales de aproximadamente 20 años de evolución. Se realizó examen físico general y dermatológico, interrogatorio y toma de fotografías por los autores del trabajo, previo consentimiento informado. Se solicitaron exámenes de rutina clínicos e imagenológicos. Fue discutido el caso en equipo multidisciplinario, planteándose como diagnóstico presuntivo un condiloma acuminado gigante o tumor de Buschke-Löwenstein y por las condiciones favorables del paciente se decide realizar cirugía convencional con biopsia del bloque, el cual informa un Carcinoma Epidermoide Grado I; se interconsulta con Oncología, prescribiéndose citostáticos. La dehiscencia y sepsis de la herida fue resuelto con antibióticos parenterales. Se programaron consultas de seguimiento con las diferentes especialidades que atendieron el paciente, con realización de exámenes clínicos e imagenológicos periódicos. Resultados: Aunque no fue descartado el carcinoma epidermoide, inicialmente el diagnóstico presuntivo fue de un condiloma acuminado gigante o tumor de Buschke-Löwenstein. Actualmente el paciente se mantiene en consultas periódicas Oncología-Dermatología, con buena evolución; cierre total de la herida con un buen resultado estético y no han aparecido recidivas del tumor. Conclusiones: Por los elementos histológicos encontrados el caso fue concluido como un Carcinoma Epidermoide Grado I; los cuales resultaron indispensables para la conducta y seguimiento postoperatorio, durante el cual se deben solicitar exámenes clínicos e imagenológicos con la periodicidad necesaria buscando signos de malignización y/o recidiva. |
► Introducción
El condiloma gigante (CG) o tumor de Buschke-Löwestein (TBL) fue descrito inicialmente por Buschke en 1886 y luego por Löwenstein, en 1925. Este es un tipo de condiloma gigante que se caracteriza generalmente por tener una base ancha con capacidad infiltrativa y destrucción a nivel local, por lo cual se producen recidivas frecuentemente, factor de riesgo para malignidad.1&
Se presenta como una lesión verrugosa, exofítica, en forma de coliflor y de lento crecimiento. A pesar de tener característica histológica benigna, puede llegar a mostrar un comportamiento agresivo, con rápido crecimiento, provocando fístula y destrucción de estructuras vecinas, con localizaciones anatómicas en boca, pene, escroto, vulva, vagina, perianal, anorrectal. Es más frecuente en hombres que en mujeres con una relación de 3:1 y está asociado a la infección por el virus del papiloma humano (VPH) tipos 6 y 11, reconocidos como de bajo riesgo de desarrollar cáncer; presenta una alta tasa de recidiva y mortalidad y existe poco consenso respecto de su tratamiento y controles post-operatorios.2&
Sin embargo la transformación maligna de estos tumores se ha reportado entre el 30 y 66 % (otros reportan entre un 30% y un 50%) 3,4& y de estos el carcinoma verrugoso es la entidad histológica mayormente asociada a dicho cambio; siendo el tratamiento por excelencia la cirugía con la eliminación completa de la lesión con o sin otras modalidades terapéuticas.5,6,7,8&
Considerada una enfermedad de transmisión sexual rara, además del VPH 9,10&, presenta otros factores de riesgo como la falta de higiene, la promiscuidad, los estados de inmunosupresión 11&, entre ellos la infección por virus de inmunodeficiencia humana (VIH), la presencia de irritación crónica, la condilomatosis recidivante y el uso de corticoides o inmunomoduladores 12&, explicando en parte su mayor incidencia en poblaciones homo y bisexual, y su comportamiento recurrente y agresivo en pacientes VIH positivos.13&
Clínicamente tiene una superficie multilobulada, friable, que puede ser de cualquier tamaño, encontrándose lesiones desde 4 cm hasta 30 a 40 cm, que pueden ser dolorosas a la palpación, con secreción o no de pus, mal olor y dependiendo de la extensión, pueden comprometer diferentes zonas. La prueba de oro para el diagnóstico es el estudio histopatológico para diferenciarlo de un carcinoma escamo celular, ya que su presentación clínica es muy similar.14,15,16&
Otros lo consideran una variante de bajo grado del carcinoma epidermoide y junto con la papilomatosis oral florida de Ackerman, la papilomatosis cutánea de Gottron y el epitelioma cuniculatum palmo plantar, pertenecen al subgrupo de carcinoma epidermoide denominado carcinoma verrucoso, postulándose como parte del espectro de lesiones que va desde la verruga genital simple hasta el cáncer epidermoide.17&
Cualesquiera que sean los términos para designar estas lesiones cutáneas, nuestro criterio es que pudiera prestarse a confusión, escogiéndose una conducta errada, sobre todo en el postoperatorio; por lo que habría que esperar por el resultado histológico para confirmación diagnóstica, como ocurrió en este caso, que a la postre resultó ser un carcinoma epidermoide grado I y como tal fue complementado la cirugía con la terapia oncológica.
► Caso clínico
Paciente masculino, raza mestiza, de 60 años de edad que refiere hace 25 años comenzó a presentar como un “granito pequeño” a nivel de la región púbica, oscuro, en forma de flor, redondeada, sin síntomas acompañantes. Acudió a su médico de familia, el cual examinó, solicitó exámenes de rutina, orientó consejería sexual preventiva y citó a nueva consulta, con su pareja sexual. Posteriormente le comenzaron a salir nuevas lesiones con similares características, en número de 3 a 4 alrededor de la antes descrita y muy numerosas en ambas regiones inguinales, casi al unísono; que con el de cursar del tiempo crecieron y se fueron uniendo para formar una “especie de cordón”, en esta última localización; siendo unas rosadas y otras oscuras.
Al cabo de 3 años aproximadamente le salía un líquido amarillo-sanguinolento con fetidez, que lo obligaba a espolvorear talco encima de las lesiones para “secar y aromatizar”. Esta conducta no prescrita por facultativo, además de uso de medicinas naturales, con aparente mejoría, además del temor para pedir ayuda a un facultativo, lo condujeron a no asistir a consulta por más de 20 años. Este cuadro se acompaña unos 2 meses antes de asistir a nuestra consulta de ardor y dolor pulsátil de moderada intensidad, que se intensifica con la deambulación y mejora con el uso de algunos analgésicos-antiinflamatorios; la exudación se hace más marcada y fétida, notando que el talco que usaba con regularidad lo empeora; haciéndose necesario el uso de varias gasas durante el día como otra medida alternativa, que no resultó efectiva, decidiendo entonces buscar ayuda médica.
► Examen Físico Dermatológico
La figura 1 (foto de la primera consulta) muestra el paciente de pie, traccionando con los dedos de su mano izquierda la base del pene y los escrotos hacia arriba e izquierda para mostrarnos; donde se aprecia lesión condilomatosa, exofítica, de gran tamaño (unos 8x16 cm), por confluencia de varios tumores de aspecto vegetantes, con tamaños que oscilan entre 3 a 5 cm, superficie multilobulada, friable, localizadas en pliegues inguinales y aparentemente en base del pene y los escrotos; ligeramente dolorosas a la palpación, de consistencia elástica, pero firmes, con discreta secreción serosa, fétida; de coloración rosada y oscuros otros, con predominio del color blanco, causado por el talco que usaba.
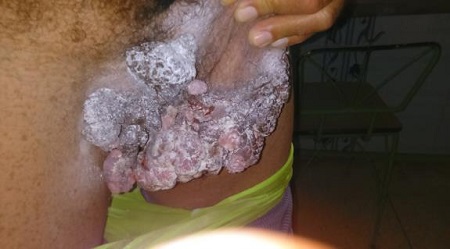
Figura 1
La figura 2 (tres días después del ingreso), el paciente tracciona con los dedos de su mano derecha la base del pene y los escrotos hacia arriba y derecha, donde se aprecian las lesiones anteriores ya tratadas tópicamente (fomentadas), lo cual condujo a la eliminación del talco, mostrándose la mayoría de color negruzco y otras de color rosado; hacia la base una de ellas, la de mayor tamaño, también rosada, pero de consistencia elástica.

Figura 2
Por encima de estas lesiones, a la inspección en región inguinal izquierda presenta un aumento de volumen, redondeado, de 6-8 cm. Con las maniobras de palpación se corrobora una hernia inguinal izquierda indirecta y en el lado derecho, de forma simétrica presenta cicatriz quirúrgica, con hernia incisional pequeña.
Posición semisentada, en la figura 3 se puede apreciar que las lesiones tienen una localización predominantemente en pliegues inguinales, a nivel del tercio medial, correspondiendo los más numerosos y de mayor volumen a la región inguinal izquierda Discretamente hay afectación del escroto izquierdo en su parte inferior, respetando el pene.
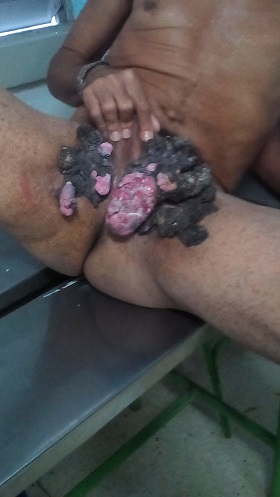
Figura 3
Al examen físico no se constató otras alteraciones en genitales externos, excepto lo antes descrito, avalados por clínica y exámenes realizados por especialistas en Urología; de igual forma se descartaron patologías anales por la especialidad de Coloproctología.
Faneras: Pelos y uñas de manos y pies normales
Antecedentes patológicos personales: Hipertensión Arterial Sistémica, afirma no haber realizado tratamientos médicos previos.
Los antecedentes familiares no mostraron nada de interés.
Fue corroborada una sola pareja sexual por más de 20 años, la cual fue examinada sin encontrar lesiones genitales; la citología vaginal resultó negativa.
Previo consentimiento informado del paciente, se tomaron fotografías por los autores del trabajo para darlo a conocer en la literatura médica, garantizando la confidencialidad de la información y protegiendo su identidad.
Los exámenes realizados de hemoquímica sanguínea, urea, creatinina, ácido úrico, colesterol, triglicéridos, serología para virus hepatitis A, B, C, HIV, serología para sífilis, ultrasonido abdominal, parcial de orina, fondo de ojo, electrocardiograma y examen radiológico de tórax fueron normales. Grupo y factor A positivo. VSG 12 mm. La tomografía computadorizada de abdomen y pelvis, mostró aumento de la densidad de partas blandas, heterogénea y bien vascularizada en regiones anatómicas antes descritas. No fue posible realizar resonancia magnética. Complementos C3 y C4 e inmunoglobulinas G, A, M, D, E resultaron normales. Es valorado por Medicina Interna y Anestesiología y con el consentimiento del paciente se decide excéresis de la lesión, con participación multidisciplinaria de Cirugía Reconstructiva, Urología, Cirugía General y Dermatología.
No fue posible realizar otros exámenes como la captura de híbridos de ácido nucleico y la reacción en cadena de la polimerasa (PCR). El paciente se negó a realizar intervención de la hernia inguinal izquierda en un segundo tiempo.
► Postoperatorio
Al 3er día de realizada la cirugía convencional se observa dehiscencia de sutura en parte superior de ingle izquierda, de aproximadamente 3 cm, con discretos signos flogísticos: eritema, edema, calor y dolor espontáneo; con escasa secreción serosa. La figura 4 b corresponde a quistes epidérmicos y la 4 a (48 horas postquirúrgico) al lugar donde se produjo la dehiscencia; cuadro controlado con dipirona por vía intramuscular si dolor (600 mg) y cefazolina (500 mg) cada 8 horas endovenosa durante 7 días, previa toma de exudado bacteriológico con cultivo y antibiograma, donde se aisló estafilococo aureus sensible a este antibiótico entre otros; además de curas locales con crema antibiótica de gentamicina al 1%.

Figura 4
Al término de este tratamiento se observa un cierre completo, con una adecuada cicatrización del resto de las heridas. A los 30 días se recibe informe histopatológico que describe proliferación de células epiteliales hacia la dermis con cambios atípicos; formación de queratina, unida por puentes intercelulares (a), con tendencia a formar globos córneos (b) y un nido suelto roto (c), todo esto compatible con Carcinoma Epidermoide bien diferenciado (Grado I), como muestra la figura 5.

Con este informe se interconsulta con Oncología, decidiendo imponer tratamiento con cisplatino a razón de 100 mg/m2, cada 21 días y 6 ciclos. Se planifica realizar controles periódicos con el objetivo de diagnosticar eventuales recidivas y/o diseminación de la enfermedad, los cuales se programan con una periodicidad mensual el primer trimestre (clínicos y de laboratorio), luego trimestral hasta el año y semestral el segundo año. Se decidió en conjunto mantener este seguimiento anual por 5 años y a partir de aquí, según evolución. Los estudios tomográficos de pelvis y abdomen cada 6 meses el primer año y luego anual.
Actualmente con 12 meses de la intervención quirúrgica se encuentra asintomático y libre de recidivas.
► Discusión
Nuestro paciente con el cuadro clínico antes descrito, buen estado general, compensación de la enfermedad de base (hemodinamicamente estable); se decidió en staf mittiing donde participaron las distintas especialidades comprometidas con el caso la realización de la cirugía; prevaleciendo el criterio que siempre el tratamiento deberá ser este, preferentemente la cirugía convencional; con escisión amplia y biopsia del bloque extraído. Se descartaron otros tratamientos inmunológicos, físicos y químicos como podofilino, crioterapia, electrocoagulación, efudix, láser CO2 o radioterapia, por considerarlos que serían poco o nada útiles para casos como el presentado o similares a este.
Esto es apoyado en lo siguiente: otros factores a considerar en el tratamiento serán el gran tamaño de las lesiones y su extensión, localización anatómica en pliegues, largo tiempo de evolución, no utilización de tratamientos previos, su estado inmunológico y el potencial oncogénico de una probable infección viral19-20&. En nuestro caso primó el primer factor, unido a las buenas condiciones hemodinámicas y físicas para la realización de la cirugía; esto y la región anatómica de las lesiones posibilitaron que no fuera necesario complementarla con otra técnica quirúrgica adicional.
Estudios realizados por diferentes investigadores en el mundo, coinciden en plantear que el carcinoma basocelular es el de más incremento, le siguen en orden de continuidad, según la literatura revisada, el carcinoma escamoso o espinocelular o epidermoide. Este último tiene diferentes sitios de aparición; también se ha reportado asociado con liquen escleroatrófico y al papiloma virus.18-21&
El carcinoma verrugoso del área anogenital se conoce también como tumor de Buschke-Löwenstein o condiloma acuminado gigante, si bien existen algunas controversias en relación con el diagnóstico del mismo. La mayor dificultad que presenta el diagnóstico del carcinoma verrugoso es su distinción de otros tumores escamosos más frecuentes como el epidermoide, con el que puede coexistir. Otros lo consideran como enfermedad pre neoplásica del carcinoma epidermoide escamoso (en el caso del pene). Para evitar errores diagnósticos, es necesario recordar y aplicar los criterios morfológicos de manera estricta. Así, el carcinoma verrugoso es un tumor constituido por células escamosas bien diferenciadas en todas las áreas, que forma grandes papilas recubiertas por una capa gruesa de paraqueratosis que invade formando bandas y nidos con borde expansivos.
Algunas de las dificultades diagnósticas que presenta el carcinoma verrugoso son provocadas por problemas de muestreo en biopsias pequeñas en las que no está representado correctamente el margen profundo o suficientes áreas características del tumor. Así, su aspecto macroscópico y de bajo aumento puede ser indistinguible del carcinoma epidermoide con crecimiento exofítica. En todos estos casos se requiere una biopsia escisional profunda, en la que se puedan identificar áreas escamosas convencionales con invasión de tipo infiltrante del estroma.22& Cuando se trata de un condiloma gigante histológicamente se puede observar intensa proliferación papilar con acantosis, paraqueratosis acentuada y mínima pérdida de polaridad de las células epiteliales; típicamente coilocitosis y binucleación celular, además de atipia celular,23& elementos no encontrados en la histología del caso relatado.
Por todo lo anterior no compartimos el criterio de considerar esta enfermedad como una entidad benigna por sí misma con comportamiento maligno, tampoco un estadio intermedio entre el carcinoma escamoso y el condiloma acuminado; lo cual nos parece términos que pueden prestarse a confusión, entre otros inconvenientes y si considerarla como un carcinoma epidermoide propiamente dicho.
Respecto a los exámenes de imágenes, su rol es determinar la extensión de la lesión y compromiso de estructuras vecinas para establecer la viabilidad de resección quirúrgica. No existe consenso sobre qué examen solicitar, sin embargo la práctica más común es realizar una resonancia magnética como primer examen debido a su mayor sensibilidad que la tomografía computada para evaluar compromiso de estructuras adyacentes, teniendo en cuenta la posibilidad de sobreestimación, debido a la reacción inflamatoria que rodea al tumor,24& que en nuestro paciente se realizó la segunda por no contar con resonador en ese momento, el cual hubiese resultado de gran utilidad para descartar infiltración en tejido graso, músculos, peritoneo u otros estructuras.
No encontramos adenopatías asociadas a esta lesión, planteándose que cuando aparecen son más bien reactivas a la lesión o a sobreinfección, muy rara vez corresponden a metástasis. 25&
Conclusiones
El caso presentado fue concluido como un carcinoma epidermoide grado I, confirmado por estudio histológico, el cual constituyó el bien llamado “patrón de oro”. La cirugía convencional resultó eficaz, considerando siempre que sea posible debe ser la primera opción en estos casos y aunque no hay unanimidad en los exámenes clínicos e imagenológicos que se deben solicitar en el período post operatorio; estos deben de realizarse con la periodicidad necesaria buscando signos de malignización y/o recidiva. Actualmente la cicatriz está bien consolidada, con un buen resultado desde el punto de vista estético y no han aparecido recidivas del tumor